Sekundárne metabolity v rode rosička (Drosera L.)RNDr. Jozef Kováčik, 2004 (Abstract) (written by MSc. Jozef Kováčik, Dept. of Botany, P. J. Šafárik University in Košice) The genus Drosera L. consists of about 125 species. Extracts from numerous species of Drosera have been traditionally used for various medicinal purposes. The main therapeutic effect of herba droserae is ascribed to content of naphthoquinones and flavonoids. Plumbagin and 7-methyljuglone are two main naphthoquinones of the genus Drosera. They have broad medicinal and other effects. They act against respiratory diseases in humans, they have antiviral, antibacterial, antifungal, anticancer properties, antispasmodic and antisclerotic effects. In Drosera plants they act as allelopathic, molluscidal, antimicrobial and antifeedant chemicals. Flavonoids are too important protective chemicals. They act as antioxidant, light screens or insect attractants in plants. In present work was studied the naphthoquinone content in different Drosera species and content of identified flavonoids in parts from flower of Drosera binata. The highest content of 7-methyljuglone was found in Drosera collinsiae and the lowest in Drosera hamiltonii. Plumbagin was detected in Drosera binata and Drosera prolifera. In parts from flower of Drosera binata were identified and quatified flavonoids isoquercitrin and astragalin. In sepals and in gynaeceum of Drosera capensis was detected 7-methyljuglone and in the same parts from flower of Drosera binata was detected plumbagin. Sekundárne metabolity V procese fotosyntézy sa u autotrofných organizmov vytvárajú organické látky, ktoré slúžia ako východiskový materiál pre sekundárny metabolizmus, čím vzniká veľké množstvo zlúčenín rôzneho zloženia a rôzneho účelu. Sekundárne metabolity sú výsledkom geneticky kódovaných a kotrolovaných a enzymaticky katalyzovaných reakcií. Označenie sekundárny slúži na označenie ich pôvodu a nie na označenie ich významu. Tieto látky majú obvykle ochrannú alebo obrannú úlohu. Zvyčajne sa tvoria v malých množstvách a podobné zlúčeniny sú charakteristické pre príbuzné taxóny (alkaloidy v čeľadi Cactaceae a pod.). Niektoré sekundárne metabolity však môžu byť prítomné u veľkého počtu taxónov (napr. niektoré flavonoidy, naftochinóny). Biosyntéza a depozícia sekundárnych metabolitov býva zvyčajne obmedzená na špeciálne bunky, pletivá alebo orgány (ako sú mliečnice rodu Euphorbia či Carica, alebo trichómy rodu Urtica) a tiež môže prebiehať len v určitej fáze ontogenézy rastliny. Sekundárne metabolity môžu byť transpotrované z miesta biosyntézy na iné miesto a môžu podliehať chemickým zmenám spočívajúcim v pripájaní alebo redukcii funkčných skupín. Po stresovom pôsobení na rastliny sa vytvárajú sekundárne metabolity označované ako fytoalexíny (Tomko et al., 1989). K sekundárnym metabolitom patria i alelopatiká (majú interakčnú funkciu), fungistatiká a baktériostatiká. U niektorých druhov karnivorných rastlín sa na rozklade živočíšnej koristi čiastočne alebo výlučne podieľajú baktérie a iné mikroorganizmy, ktorých činnosť je regulovaná pomocou organických kyselín s baktériostatickými účinkami. Často ide o kyselinu benzoovú (Studnička, 1984). Sekundárne metabolity rodu Drosera L. Zo sekundárnych metabolitov sú u rosičiek najlepšie preskúmané naftochinóny a flavonoidy, ktorým sa pripisujú biologické účinky drogy (Šamaj et al., 1999). Naftochinóny Sú chinónové zlúčeniny naftalénu. Možu mať pripojenú cukornú zložku (glykozidy) alebo ju nemajú (tzv. aglykóny). Molekula pozostáva z 10 atómov uhlíka. Jednotlivé molekuly naftochinónov sa líšia polohou metylových a hydroxylových skupín. Prekurzorom naftochinónov je kyselina šikimová. Tieto z nej vznikajú dvoma spôsobmi: A) z kyseliny šikimovej cez tyrozín a kyselinu homogentízovú vzniká toluchinón a pripojením izoprénovej jednotky a ďalšími reakciami vzniká substituovaný naftochinón, ktorého chinónový kruh pochádza z kyseliny šikimovej (schéma A) - uhlíky označené bodkami. B) kyselina šikimová reaguje s kyselinou α-ketoglutárovou za vzniku kyseliny o-sukcinylbenzoovej, z ktorej cez kyselinu 4-hydroxytetralónkarboxylovú vzniká naftochinón typu juglón alebo drozerón. Pri tejto biosyntéze z kyseliny šikimovej pochádza benzénový kruh a len jeden uhlíkový atóm chinónového kruhu (schéma B), (Tomko et al., 1989): 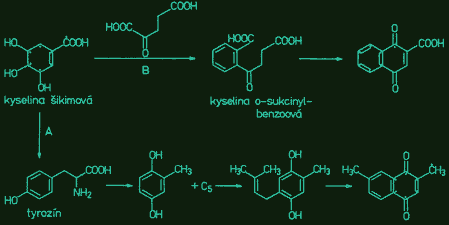 Naftochinóny sa u kvitnúcich rastlín vyskytujú rozptýlene a je známe ich široké rozšírenie v hubách, lišajníkoch a dokonca u niektorých pavúkov (Culham, Gornall, 1994). Naftochinóny sú charakteristické pre celú čeľaď Droseraceae, potvrdili sa i v rodoch Dionaea, Aldrovanda a Drosophyllum (Culham, Gornall, 1994). Historicky naftochinóny ako prvý spomína Lindley (1839), ktorý popisuje zlúčeniny purpurovej farby z hľúz austrálskych druhov rosičiek, ktoré farbia papier v ktorom sú skladované. Prvýkrát naftochinóny izoloval Rennie (1887, 1893) z hľúz Drosera whittakeri. Boli to drozerón, neskôr identifikovaný ako 3,5-dihydroxy-2-metyl-1,4-naftochinón a hydroxydrozerón, identikfikovaný ako 3,5,8-trihydroxy-2-metyl-1,4-naftochinón (Culham, Gornall, 1994). Aglykóny drozerón a hydroxydrozerón sú prítomné v rode Drosera v minoritných množstvách a v nadzemných častiach raslín sa vyskytujú veľmi málo a zistili sa i v rode Nepenthes (Culham, Gornall, 1994), ktorý spolu s rodom Drosera patrí do radu Polygonales. V rôznych druhoch rodu Drosera sa zistili glykozidické formy drozerón-5-glukozid a hydroxydrozerón-5-glukozid (Šamaj et al., 1999). Culham a Gornall (1994) udávajú obsah minoritných naftochinónov na úrovni menej ako 1/10 koncentrácie majoritných zlúčenín.   drozerón hydroxydrozerón Ďalšími známymi minoritnými naftochinónovými derivátmi sú diomusción a diomuscipulón, ktoré boli identifikované v Dionaea muscipula (Miyoshi et al., 1984) a vyskytujú sa v extrémne nízkych množstvách (diomusción 0,0006 %; diomuscipulón 0,001 %). Naftochinóny prítomné vo väčších množstvách sú 7-metyljuglón a plumbagín (Culham, Gornall, 1994). U krytosemenných rastlín je 7-metyljuglón (5-hydroxy-7-metyl-1,4-naftochinón) prevládajúci chinón v čeľadi Ebenaceae a plumbagín (5-hydroxy-2-metyl-1,4-naftochinón) je značne zastúpený v čeľadiach Plumbaginaceae a Iridaceae (Thomson, 1987). Biosyntéza naftochinónov v čeľadi Plumbaginaceae je rovnaká ako v čeľadi Droseraceae (Durand, Zenk, 1971). Z naftochinónov je v rode Drosera najviac zastúpený aglykón 7-metyljuglón, druhý najvýznamnejší aglykón je plumbagín (Bonnet et al., 1984). Plumbagín sa zistil i v rode Nepenthes (Cannon et al., 1980) a v rodoch Triphyophyllum a Dioncophyllum čeľade Dioncophyllaceae (Bruneton et al., 1976).   7-metyljuglón plumbagín Bringmann a Feineis (2001) popísali novú biosyntetickú cestu vzniku naftylizochinolínových alkaloidov v čeľadi Dioncophyllaceae, kam patrí i Triphyophyllum peltatum. V pokusoch s kalusovými kultúrami tejto rastliny, ktorá je považovaná za karnivornú sa zistilo, že v podmienkach chemického, fyzikálneho alebo biotického stresu sa zastavuje tvorba izochinolínovej časti molekuly alkaloidu a naftalénová časť sa akumuluje vo forme naftochinónov ako plumbagín alebo drozerón. Taxonomickým významom naftochinónov v čeľadi Droseraceae sa zaoberali Culham a Gornall (1994). V rámci rodu Drosera zistili, že distribúcia 7-metyljuglónu a plumbagínu neumožňuje navrhnúť výrazné taxonomické rozčlenenie, nakoľko i veľmi príbuzné taxóny (napr. poddruhy Drosera stolonifera) nemusia obsahovať ten istý majoritný naftochinón. Preto navrhli, s ohľadom na relatívne zastúpenie oboch majoritných naftochinónov a ostatné morfologické znaky, rozdeliť rod Drosera do dvoch podrodov: Drosera - prevažujúcim je 7-metyljuglón, často sprevádzaný plumbagínom a sem zaradili i sekcie austrálskych druhov, ktoré zrejme nemajú žiadnu z týchto látok a Ergaleium - dominantným chinónom je plumbagín. Takéto členenie rodu Drosera navrhol už De Candolle (1824). Z in vitro pestovaných rastlín Drosera spatulata boli okrem známeho 7-metyljuglónu izolované i atrefakty 2- a 3-metoxy-7-metyljuglón, ktoré vznikajú pri extrakcii s metanolom. Izoloval sa i rossolizid (7-metyl-1,4,5-trihydroxynaftalén-4-O-glukozid), známy z druhu Drosera rotundifolia (Budzianowski, 1995). Z in vitro pestovaných rastlín Drosera rotundifolia a Drosera spatulata sa izoloval artefakt 2-metylnaftazarín (5,8-dihydroxy-2-metyl-1,4-naftochinón) 5-O-glukozid, ktorý vzniká z rossolizidu počas extrakcie s metanolom (Budzianowski, 1997). Predpokladanou funkciou naftochinónov je ich antimikrobiálne pôsobenie počas trávenie koristi (Culham, Gornall, 1994). Tiež sa predpokladá ich alelopatické (Harborne, 1982; Reynolds, 1987), insekticídne, moluscídne a antiherbivorné pôsobenie (Thomson, 1987). Flavonoidy Flavonoidy sú polyfenolové zlúčeniny bežne sa vyskytujúce v rastlinách. Často zodpovedajú za ich základné fyziologické funkcie ako napr. farba, lákanie opelovačov, ochrana pred UV žiarením (nakoľko absorbujú v UV oblasti spektra), ochrana pred patogénmi a i. Názov dostali podľa žltého sfarbenia mnohých zlúčenín (z latinského flavus = žltý). V súčasnosti je popísaných viac ako 4000 druhov flavonoidov (Mojžiš, Mojžišová, 2001). Flavonoidy sú charakteristické flavánovým skeletom. Sú to látky s nízkou molekulovou hmotnosťou a charakteristickou tricyklickou štruktúrou. Molekula obsahuje dva benzénové kruhy, ktoré sú spojené heterocyklom s kyslíkom, ktorým je buď α-pyrón (flavonoly a flavóny) alebo jeho dihydroderivát (flavanoly a flavanóny). Kruh C nesie benzoidný kruh B ako substituent. Podľa pozície kruhu B sa rozlišujú flavonoidy (pozícia 2) a izoflavonoidy (pozícia 3). Ďalšie delenie flavonoidov je založené na prítomnosti/neprítomnosti dvojitej väzby na 4 uhlíku kruhu C, prítomnosti/neprítomnosti dvojitej väzby medzi 2 a 3 uhlíkom kruhu C a prítomnosti hydroxylových skupín v kruhu B (Mojžiš, Mojžišová, 2001). Na základe týchto skutočností je možné vyčleniť niekoľko podskupín flavonoidov, napr. chalkóny, flavanóny, flavóny, flavonoly. 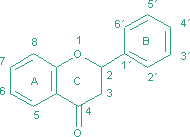 Základná štruktúra flavonoidov V rastlinách sa flavonoidy syntetizujú z aromatických aminokyselín fenylalanínu a tyrozínu, ktoré sú konvetrované enzýmami fenylalanínlyázou alebo tyrozínlyázou na kyselinu cinamovú a kyselinu parahydroxycinamovú. Kondenzáciou cinamových kyselín s acetátom vzniká cinamoylová štruktúra flavonoidov. Ďalšou kondenzáciou orto-hydroxyacetofenónu s derivátmi benzaldehydu vznikajú chalkóny a flavanóny a podobne kondenzáciou orto-hydroxyacetofenónu s derivátmi kyseliny benzoovej vznikajú 2-hydroxyflavanóny a flavóny ( Mojžiš, Mojžišová, 2001 ). Flavonoidy sa vyskytujú buď voľne ako aglykóny, alebo s naviazanou cukornou zložkou (glykozidy). Glykozidy flavánových derivátov majú cukor naviazaný na hydroxyly kruhu A alebo na heterocyklus, najčastejšie na jeho hydroxyl na 3. atóme uhlíka. Chalkóny nie sú pravé flavánové deriváty, pretože nemajú prostredný heterocyklus. Ľahko prechádzajú, najmä v kyslom prostredí do flavanónov. V biosyntéze flavánových derivátov však majú ústredné postavenie. Glykozidy chalkónov sú prítomné vo väčšom množstve v žltých kvetoch niektorých druhov čeľadí Asteraceae a Viciaceae. Flavóny majú v heterocykle o jednu dvojitú väzbu viac ako flavanóny. Do tejto skupiny látok patria napr. apigenín, luteolín, baikaleín. Naviazaním jedného hydroxylu v polohe 3 na stredný kruh flavónov vznikajú flavonoly. Bežnými flavonolovými aglykónmi sú kempferol a kvercetín, kvercetín je široko rozšírený v rastlinnej ríši (Repčák et al., 2000). Flavonolové glykozidy podmieňujú belavé až svetlo žlté zafarbenie kvetov a vyskytujú sa vo všetkých častiach rastliny. 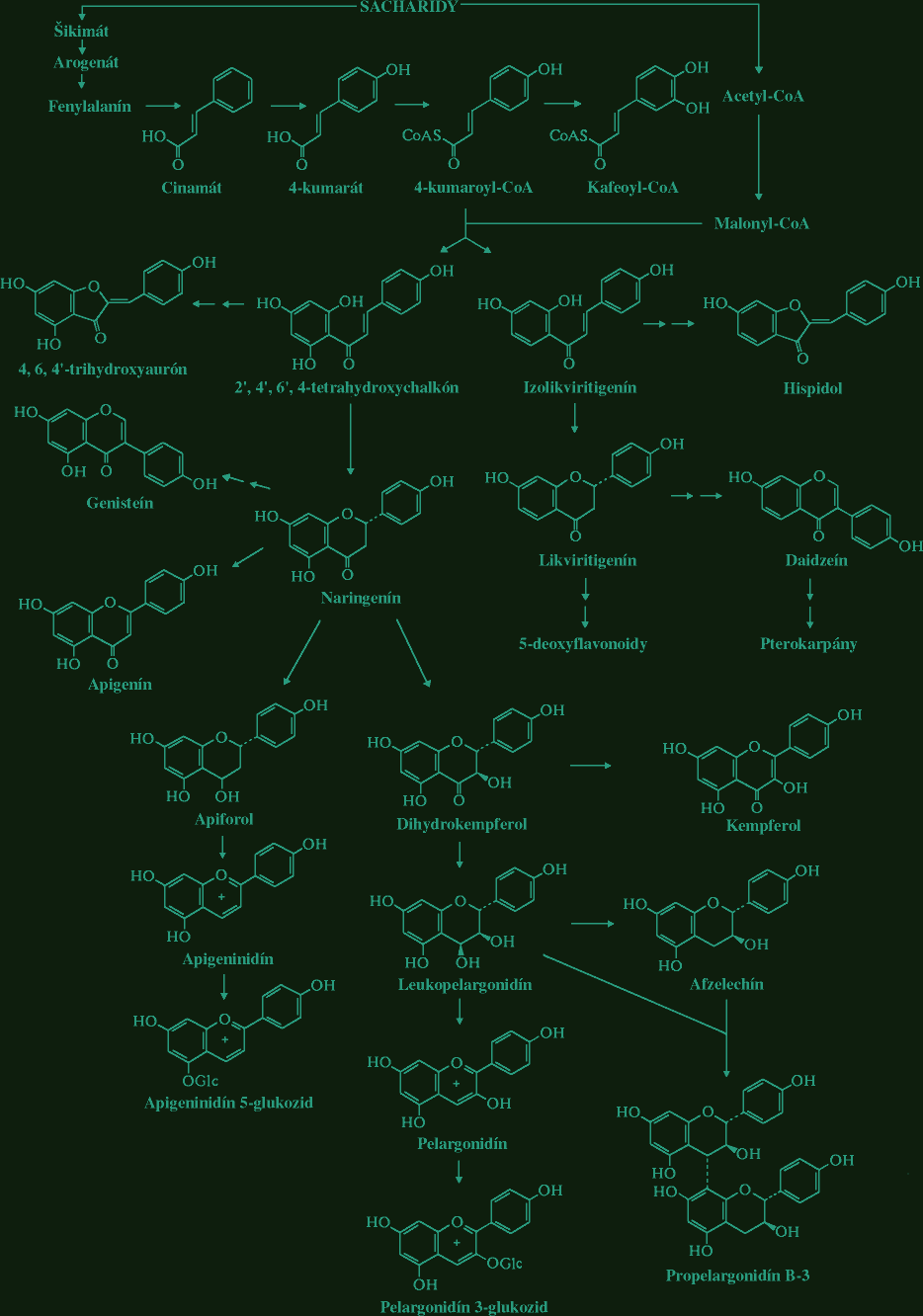 Schéma biosyntézy hlavných flavonoidov (Harborne, 1994). Rod Drosera obsahuje široké spektrum flavonoidov a flavonoidných glykozidov, napr. kvercetín, kempferol, izokvercitrín, astragalín, hyperín, gossypín, gossypitrín (Šamaj et al., 1999). Flavonoidy v rode Drosera boli skúmané v in vivo aj v in vitro pestovaných rastlinách. Budzianowski et al. (1993) skúmali prítomnosť flavonoidov v in vitro pestovaných rastlinách druhov Drosera intermedia a Drosera spatulata. V oboch druhoch zistili prítomnosť astragalínu a izokvercitrínu a dalšie flavonoidy, napr. myricetín-3-O-ramnozid, kvercetín-3-O-ramnozid, kvercetín-3-O-galaktozid, kempferol-3-O-galaktozid. V druhu Drosera rotundifolia sa zistili aglykóny kvercetín, kempferol a gossypetín a ich glykozidické formy izokvercitrín, astragalín a gossypitrín = gossypetín-7-glukozid (Repčák et al., 2000). 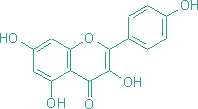  kempferol kvercetín   astragalín izokvercitrín Repčák a Galambosi (1996) skúmali obsah flavonolov kempferolu a kvercetínu v in vivo rastúcich rastlinách Drosera rotundifolia a Drosera anglica vo Fínsku. Zistili výrazne vyšší obsah kvercetínu (3,61 % - 6,40 %) vo všetkých analyzovaných častiach rastlín oboch druhov v porovnaní s kempferolom (0,07 % - 0,45 %). Obsah kempferolu a kvercetínu v rastlinách Drosera rotundifolia a Drosera anglica, pestovaných v rašeline vo Fínsku, skúmali Galambosi et al. (2000). Pri tomto pokuse sa sledoval i vplyv doplnkovej výživy (práškové mlieko) na obsah sledovaných látok. Opätovne sa u oboch druhov zistila výrazne vyššia akumulácia kvercetínu (3,30 % - 6,37 %) v porovnaní s kempferolom (0,04 % - 0,55 %) vo všetkých analyzovaných častiach rastlín, bez ohľadu na spôsob zakladania porastu a doplnkovú výživu (analyzovali sa dvojročné rastliny). Z výsledkov získaných z dvojročných rastlín vyplýva, že aplikácia práškového mlieka mala na akumuláciu kempferolu a kvercetínu u Drosera rotundifolia jednoznačne nepriaznivý vplyv, kým u Drosera anglica sa zaznamenal pokles i vzostup akumulácie uvedených aglykónov v jednotlivých analyzovaných častiach. Účinky a využitie herba droserae Biologické účinky naftochinónov Naftochinónom sa pripisuje pôsobenie proti respiračným ochoreniam u človeka vrátane účinkov proti astme, bronchiálnym infekciám, čiernemu kašľu a tuberkulóze. V tomto smere sa skúmalo najmä pôsobenie plumbagínu. U tejto látky sa zistil inhibičný vplyv na enzýmovú aktivitu, pôsobenie proti parazitickým nematódam a hmyzu (Šamaj et al., 1999). Plumbagín tiež pôsobí proti arterioskleróze, má antibiotické účinky na stafylokoky, niektoré patogénne huby a prvoky. Účinkuje antiskleroticky a má podobné účinky ako vitamín K. Podporuje potenie a uvoľňovanie žlče. Má spazmolytické a upokojujúce účinky a na nervové a svalové tkanivo pôsobí stimulačne (Bentelhauser,Blanárik, 1991). Bolo dokázané, že naftochinóny majú antivírusové, antibakteriálne, protihubové a protirakovinové pôsobenie a zistilo sa, že pôsobia i ako afrodiziakum (Šamaj et al., 1999). Minoritný naftochinón drozerón brzdí množenie tuberkulóznych bacilov, streptokokov, stafylokokov a má aj spazmolytické a iné účinky. Biologické účinky flavonoidov Škála biologických účinkov flavonoidov je široká. Boli popísané ich účinky antioxidačné, antineoplastické, antimutagénne, protizápalové, antidiabetické, antialergické, antiaterosklerotické a iné (Mojžiš, Mojžišová, 2001). Hlavným zdrojom flavonoidov pre ľudský organizmus je potrava rastlinného pôvodu. Vysoký obsah flavonoidov má napr. cibuľa, citrusové plody, jablká, ale i čaj alebo káva. Odhady denného príjmu flavonoidov sa pohybujú v rozmedzí od 50 do 1000 mg, pričom kempferol a kvercetín sú dva najviac sa vyskytujúce flavonoidy (Mojžiš, Mojžišová, 2001). Flavonoidy zvyšujú pružnosť, elastickosť a znižujú lámavosť kapilárnych stien. Zvyšujú deformabilitu erytrocytov. Majú spazmolytický účinok na hladké svaly (vrátene hladkých svalov ciev, čím zlepšujú prietok krvi), pričom aglykóny majú tento účinok silnejší ako glykozidy. Flavonoidy zlepšujú kontrakcie srdcového svalu a zvyšujú minútový objem srdca. Pozoruhodná je schopnosť niektorých flavonoidov ovplyvniť virulenciu HIV. Tan et al. (1992) v rámci svojej štúdie zistili, že aj niektoré flavonoidy signifikantne inhibovali reverznú transkriptázu u oboch druhov HIV a v prípade, že boli neúčinné u HIV-1, boli neúčinné i u HIV-2. Nakane et al. (1990) sledovali vplyv epikatechín galátu a epigalokatechín galátu (zložky zeleného čaju) na aktivitu reverznej transkriptázy a bunkovú DNA a RNA polymerázu a zistili najsignifikantnejší účinok pri inhibícii reverznej transkriptázy u HIV, kde obe sledované zlúčeniny kompetitívne inhibovali enzým už v koncentráciách 0,01-0,02 mg/ml. Ono et al. (1990) zistili, že reverznú transkriptázu u HIV tiež signifikantne inhibovali kvercetín a myricetín pri koncentrácii 2,0 mg/ml. Niektoré flavonoidy môžu okrem priameho inhibičného vplyvu na enzýmy HIV znižovať virulenciu vírusu i blokovaním jeho adsorpcie na bunkový povrch. Takéto pôsobenie zistil Li et al. (2000) u baikalínu, izolovaného z rastliny Scutellaria baicalensis Georgi. Flavonoidy baikalín a štruktúrne podobný baikaleín sa v súčasnosti intenzívne skúmajú i pre svoje protizápalové a protibakteriálne účinky (Mojžiš, Mojžišová, 2001).  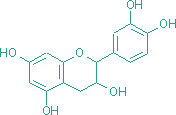 baikaleín epikatechín Metódy V tejto práci sa skúmal obsah majoritných naftochinónov 7-metyljuglónu a plumbagínu v listoch vybraných druhov rodu Drosera L. a obsah glykozidických flavonoidov izokvercitrínu a astragalínu v častiach kvetu Drosera binata. Obsah naftochinónov sa stanovil v čerstvých listoch a obsah flavonoidov v suchom materiáli metódou HPLC. Vysokoúčinná kvapalinová chromatografia (HPLC) HPLC je kolónová chromatografia, umožňujúca separáciu a stanovenie látok v roztoku. Kvapalinový chromatograf pozostáva z častí zabezpečujúcich transport mobilnej fázy, dávkovanie vzorky, separáciu látok a ich detekciu. Kolóny sú vyrobené z nerezovej ocele alebo z vysokopevného skla. Kolóna je naplnená sorbentom s veľkosťou častíc od 5 do 50 mm. Dĺžka kolóny závisí od použitého sorbentu. Volí sa tým kratšia kolóna, čím je veľkosť častíc sorbentu menšia. Vnútorný priemer kolóny nepresahuje 3 až 6 mm. Pri HPLC sa na rozdiel od klasickej kvapalinovej chromatografie používa vysoká rýchlosť mobilnej fázy ( 1 - 100 cm/s), ktorá sa dosahuje použítím vysokých tlakov. Delenie separovaných látok môže prebiehať dvoma spôsobmi. Pri izokratickom usporiadaní sa zloženie mobilnej fázy počas analýzy nemení. Vyššia účinnosť delenia sa dosahuje gradientom. Na detekciu separovaných látok sa často používa spektrofotometrický detektor s meniteľnou vlnovou dĺžkou v ultrafialovej a viditeľnej oblasti. Kvantitatívne stanovenie 7-metyljuglónu a plumbagínu v Drosera sp. Pre stanovenie obsahu naftochinónov sa odoberali plne funkčné listy porovnateľného veku. Čerstvý list sa zhomogenizoval v trecej miske a extrahoval s benzénom. Extrakt sa odparil v RVO a odparok sa rozpustil etanolom a analyzoval metódou HPLC. Ako vnútorný štandard sa použil juglón (Fluka). Paralelne sa stanovila sušina po vysušení do konštantnej hmotnosti pri 105° C. Na kvantifikáciu naftochinónov sa použila izokratická metóda HPLC. Kvantitatívne stanovenie flavonoidov v Drosera binata Labill. Flavonoidy sa stanovili v suchom rastlinnom materiáli v týchto častiach kvetu: kalich, koruna, tyčinky, piestik. Vzorka sa zhomogenizovala v studenej trecej miske a extrahovala so 75 % metanolom. Na stanovenie flavonoidov sa použila gradientová metóda HPLC. Na identifikáciu a kalibráciu sa použili štandardné zlúčeniny izokvercitrínu (Roth) a astragalínu (Roth). Naftochinóny niektorých druhov rodu Drosera L. V deviatich z jedenástich hodnotených druhov rodu Drosera L. (D. collinsiae, D. capensis, D. communis, D. venusta, D. admirabilis, D. spatulata, D. burkeana, D. adelae a D. hamiltonii) sa zistila prítomnosť naftochinónu 7-metyljuglónu a v druhoch D. binata a D. prolifera prítomnosť plumbagínu (tab. 1). Použitou izokratickou metódou HPLC bolo možné podľa TR rozlíšiť oba naftochinóny (obr. 1). Na potvrdenie identity látok sa tiež využilo meranie UV-VIS spektier počas analýzy (obr. 2). x - priemerná hodnota (mg látky/g sušiny); SD - smerodajná odchýlka; min./max. - minimálna/maximálna zistená hodnota (mg látky/g sušiny); n = 6
Pre stanovenie obsahu naftochinónov sa odobrali plne funkčné listy porovnateľného veku zo šiestich rôznych rastlín každého druhu. Obsah naftochinónov v skúmaných druhoch bol značne variabilný (tab. 1). Najnižší obsah 7-metyljuglónu sa zaznamenal v sušine listov Drosera hamiltonii (3,83 mg/g) a najvyšší obsah v sušine listov Drosera collinsiae (45,98 mg/g). Obsah plumbagínu v listoch oboch skúmaných druhov bol vysoký.  Obr. 1. Chromatogram (HPLC) naftochinónov 7-metyljuglónu a plumbagínu v extraktoch listov Drosera capensis a Drosera binata.  Obr. 2. UV-VIS spektrá plumbagínu a 7-metyljuglónu zmerané počas HPLC analýzy extraktov listov Drosera binata a Drosera capensis. Nakoľko Repčák a Galambosi (1994) zistili závislosť obsahu naftochinónov od ontogenetického štádia listu, vyberali sa pre analýzy čo najmladšie, plne vyvinuté a plne funkčné listy porovnateľného veku. Obsah 7-metyljuglónu v druhoch Drosera anglica a Drosera rotundifolia (zbieraných v prírode) v závislosti od vývinového štádia listu skúmali Repčák et al. (2000). Najvyšší obsah uvedenej látky zistili v mladých a v dospelých zelených listoch (2,70 % v sušine D. rotundifolia; 1,94 % v sušine D. anglica), kým v starších listoch sfarbených do červena bol obsah 7-metyljuglónu nižší (0,04 % v D. rotundifolia; 0,34 % v D. anglica). Vysoký obsah tejto látky sa zistil v kvetoch oboch druhov (1,94 % v D. anglica; 3,14 % v D. rotundifolia). S červeným sfarbením listov a nízkym obsahom 7-metyljuglónu bola spojená prítomnosť dvoch neidentifikovaných červených pigmentov (Repčák, Galambosi, 1994). Obsah 7-metyljuglónu v rastlinách Drosera anglica a D. rotundifolia pestovaných v rašeline vo Fínsku skúmali Galambosi et al. (2000). V dvojročných rastlinách oboch druhov bol obsah 7-metyljuglónu vyšší pri priamom výseve v porovnaní s presádzanými rastlinami. Obsah naftochinónov 7-metyljuglónu a plumbagínu v pestovaných druhoch rodu Drosera a zmeny ich obsahu počas vegetačného obdobia skúmali Caniato et al. (1989) v druhoch Drosera binata, Drosera binata var. dichotoma a Drosera capensis. Zistili, že plumbagín je v Drosera binata a v D. binata var. dichotoma prítomný vo všetkých častiach rastliny a vyskytoval sa v každom skúmanom ontogenetickom štádiu. Rovnaké výsledky zistili i pre 7-metyljuglón v Drosera capensis. Z výsledkov tiež vyplýva, že plumbagín sa v uvedených druhoch akumuluje viac v koreňoch ako v nadzemných orgánoch. Vysoký obsah 7-metyljuglónu v rastlinách Drosera capensis sa zistil počas celého vegetačného obdobia a k celkovému obsahu naftochinónov v jednej rastline nadzemné časti prispievali viac ako korene. Pre porovnanie sa analyzovali rastliny Drosera rotundifolia z prírodných lokalít a zistilo sa, že ich celkový obsah naftochinónov v jednej rastline bol v priebehu vegetačného obdobia 200 až 450 krát nižší ako v Drosera binata var. dichotoma. V rastlinách Drosera binata zistili priemerný obsah plumbagínu v nadzemných častiach (stanovený v čerstvej hmotnosti) počas vegetačného obdobia u rastlín rozmnožovaných delením 0,225 % a v rastlinách rozmnožovaných koreňovými odrezkami 0,305 %. V tomto druhu sa v rastlinách pestovaných v skleníku Botanickej záhrady UPJŠ v Košiciach zistil priemerný obsah 0,309 % plumbagínu v čerstvých listoch. V Drosera capensis zistili priemerný obsah 7-metyljuglónu v nadzemných častiach (stanovený v čerstvej hmotnosti) počas vegetačného obdobia v rastlinách rozmnožovaných delením 0,105 % a v rastlinách rozmnožovaných koreňovými odrezkami 0,095 %. V tomto druhu sa v rastlinách pestovaných v skleníku Botanickej záhrady UPJŠ v Košiciach zistil priemerný obsah 0,357 % 7-metyljuglónu v čerstvých listoch. Z uvádzanej práce vyplýva, že skúmané druhy sú nenáročné na kultiváciu v skleníkových podmienkach a sú vhodným zdrojom 7-metyljuglónu a plumbagínu. Hook et al. (1997) uvádzajú priemerný obsah 7-metyljuglónu v in vitro kultúre Drosera capensis pre výhonky 0,50 % a pre korene 0,17 %. Hodnota uvedená pre korene je podobná hodnote zistenej v koreňoch in vivo pestovaných rastlín Drosera capensis (Caniato et al., 1989). Kvantitatívne údaje o obsahu naftochinónov v iných druhoch, ktoré sa skúmali v tejto práci som v dostupnej literatúre publikované nenašiel. Flavonoidy niektorých druhov rodu Drosera L. V analyzovaných častiach kvetu Drosera binata Labill. boli identifikované flavonoidy astragalín a izokvercitrín. Použitou gradientovou metódou bolo možné podľa TR rozlíšiť obe látky (obr. 3). Na identifikáciu sa použili štandardné zlúčeniny izokvercitrínu a astragalínu (Roth). Obsah astragalínu a izokvercitrínu v častiach kvetu Drosera binata je uvedený v tabuľke 3. Najnižší obsah izokvercitrínu sa zaznamenal v tyčinkách (7,68 mg/g sušiny) a najvyšší obsah v korune (43,02 mg/g sušiny). Najnižší obsah astragalínu sa zaznamenal v piestiku (1,30 mg/g sušiny) a najvyšší obsah v korune (99,77 mg/g sušiny). Pre stanovenie obsahu flavonoidov sa použili jednotlivé časti kvetu pochádzajúce zo súkvetí troch rôznych rastlín Drosera binata. x - priemerná hodnota (mg látky/g sušiny); SD - smerodajná odchýlka; min./max. - minimálna/maximálna zistená hodnota (mg látky/g sušiny); n = 3
Pre potvrdenie glykozidického zloženia stanovovaných látok sa uskutočnila kyslá hydrolýza metanolového extraktu petalov Drosera binata (obr. 4). Z obrázku vyplýva, že po kyslej hydrolýze sa zo skúmaných látok uvoľnili aglykóny kempferol (z astragalínu) a kvercetín (z izokvercitrínu), ktoré predtým v extrakte prítomné neboli. Prítomnosť izokvercitrínu a astragalínu sa zistila i v častiach kvetu Drosera capensis (obr. 5). Na obrázku 6 je UV-VIS spektrum neidentifikovanej látky z petalov druhu Drosera capensis zmerané počas HPLC analýzy. Táto látka absorbovala pri rovnakej vlnovej dĺžke ako stanovované flavonoidy a preto sa predpokladalo, že sa jedná o flavonoidnú látku. Po kyslej hydrolýze extraktu a jeho opätovnom analyzovaní sa chromatogram nezmenil, len v ňom nebola prítomná uvedená látka. Z toho vyplýva, že daná látka nie je flavonoidom, ale má aromatický charakter. U Drosera binata i Drosera capensis sa v piestiku a kalichu zistila prítomnosť naftochinónov. U Drosera binata sa zistil plumbagín (obr. 3) a u Drosera capensis sa zistil 7-metyljuglón (obr. 5).  Obr. 3. HPLC chromatogramy metanolových extraktov častí kvetu Drosera binata. K - kalich; C - koruna; A - tyčinky; G - piestik; i - izokvercitrín; a - astragalín.  Obr. 4. HPLC chromatogram metanolového extraktu korunných lupienkov Drosera binata (E) a jeho kyslého hydrolyzátu (AH). i - izokvercitrín; a - astragalín; qe - kvercetín; ke - kempferol 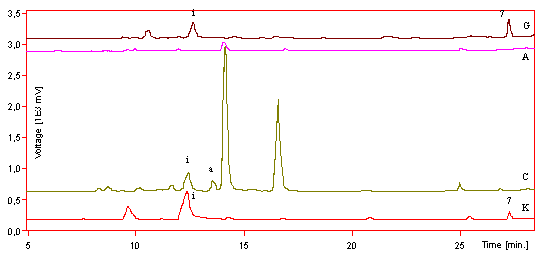 Obr. 5. HPLC chromatogramy metanolových extraktov častí kvetu Drosera capensis. K - kalich; C - koruna; A - tyčinky; G - piestik; i - izokvercitrín; a - astragalín; 7 - 7-metyljuglón.  Obr. 6. UV-VIS spektrum neidentifikovanej látky z korunných lupienkov Drosera capensis zmerané počas HPLC analýzy (Obr. 5-C, TR - 14,2). Kvantitatívne údaje o akumulácii izokvercitrínu a astragalínu som v dostupnej literatúre nenašiel pre žiadny druh rodu Drosera. Rovnako vo všetkých dostupných prácach sa flavonoidy stanovili v celých kvetoch a skúmané boli hlavne druhy Drosera rotundifolia a Drosera anglica, alebo in vitro pestované druhy. V tejto práci sa flavonoidy stanovili v jednotlivých častiach kvetu. Kvantitatívne údaje o akumulácii stanovených látok, alebo o akumulácii iných flavonoidov v jednotlivých častiach kvetu som v dostupnej literatúre nenašiel pre žiadny druh rodu Drosera a pravdepodobne ešte neboli publikované. V práci sa skúmal obsah naftochinónov v listoch niektorých druhov rodu Drosera L. a obsah hlavných flavonoidov v kvetoch Drosera binata Labill. Z práce vyplývajú nasledovné závery: 1. Obsah naftochinónov v skúmaných druhoch rodu Drosera L. bol značne variabilný. Najnižší obsah 7-metyljuglónu sa zaznamenal v sušine listov Drosera hamiltonii (3,83 mg/g sušiny) a najvyšší obsah v sušine listov Drosera collinsiae (45,98 mg/g sušiny). Druhy Drosera binata a Drosera prolifera akumulujú plumbagín. 2. V častiach kvetu Drosera binata Labill. sa zistila prítomnosť flavonoidov astragalínu a izokvercitrínu. Najnižší obsah izokvercitrínu sa zaznamenal v tyčinkách (7,68 mg/g sušiny) a najvyšší obsah v korune (43,02 mg/g sušiny). Najnižší obsah astragalínu sa zaznamenal v piestiku (1,30 mg/g sušiny) a najvyšší obsah v korune (99,77 mg/g sušiny). 3. Prítomnosť flavonoidov astragalínu a izokvercitrínu sa zistila i v častiach kvetu Drosera capensis. Pre nedostatok materiálu nebol ich obsah kvantifikovaný. 4. V petaloch Drosera capensis sa zistila aromatická látka, ktorú sa nepodarilo identifikovať. 5. V kalichu a v piestiku Drosera capensis sa zistila prítomnosť naftochinónu 7-metyljuglónu. V tých istých častiach kvetu Drosera binata sa zistil plumbagín. Literatúra Bentelhauser, M., Blanárik, I., (1991): Liečivé a fyziologické účinky mäsožravých rastlín. Drosera, 1(2), 10. Bonnet, M., Coumans, M., Hofinger, M., Ramaut, J. L., Gaspar, Th., (1984): High-performance gas chromatography of 1,4-naphthoquinones from Droseraceae. Chromatografia, 18, 621 - 622. Bringmann, G., Feineis, D., (2001): Stress - related polyketide metabolism of Dioncophyllaceae and Ancistrocladaceae. Journal of Experimental Botany, 52(363), 2015 - 2022. Bruneton, J., Bouquet, A., Fournet, A. and Cavé, A., (1976): La triphyophylline, nouvel alcoloid isolé du Triphyophyllum peltatum. Phytochemistry, 15, 817 - 818. Cit. in Culham, Gornall, 1994. Budzianowski, J., Skrzypcak, L., Kukułcanka, K., (1993): Phenolic compounds of Drosera intermedia and Drosera spatulata from in vitro cultures. Acta. Hortic., 330, 277 - 280. Budzianowski, J., (1995): Naphthoquinones of Drosera spatulata from in vitro cultures. Phytochemistry, 40(4), 1145 - 1148. Budzianowski, J., (1997): 2-methylnaphthazarin 5-O-glucoside from the methanol extracts of in vitro cultures od Drosera species. Phytochemistry, 44(1), 75 - 79. Caniato, R.,Filippini, R., Cappelletti, E. M., (1989): Naphthoquinone contents of cultivated Drosera species Drosera binata, Drosera binata var. dichotoma and Drosera capensis. Int. J. Crude Drug., 27(3), 129 - 136. Cannon, J. R., Lojanapiwatna, R. C. L., Sinchai, W. and White A. H., (1980): The quinones of Nepenthes rafflesiana. Austral. J. Chem., 33, 1073 - 1093. Cit. in Culham Gornall, 1994. Culham A., Gornall, R. J., (1994): The taxonimic significance of naphthoquinones in Droseraceae. Biochem. Syst. And Ecol., 22(9), 507 - 515. De Candolle, A. P., (1824): Droseraceae. Prodromus Systematics Naturalis Regni Vegetabilis, Paris, 1, 317 - 320. Cit. in Culham, Gornall, 1994. Durand, R., Zenk, M. H., (1971): Biosynthesis of plumbagin via the acetate pathway in higher plants. Tet. Lett., 32, 3009 - 3012. Cit. in Culham, Gornall, 1994. Galambosi, B., Galambosi, Zs., Repčák, M., (2000): Growth, yield and secondary metabolites production of Drosera species cultivated in peat beds in Finland. SOU, 51(2), 47 - 57. Harborne, J. B., (1982): Introduction to Ecological Biochemistry. 2nd edition, Academic Press, London. Cit. in Culham, Gornall, 1994. Harborne, J. B., (1994): The Flavonoids. Chapman ? Hall, London, 676 pp. Hook, I., Walsh, J., Kavanagh, P., Reininger, R., (1997): Naphtoquinone production by cultures of cape sundew (Drosera capensis). Pharm. Pharmacol. Lett., 7, 93 - 95. Li, B. Q., Fu, T., Dongyan, Y., Mikovits, J. A., Ruscetti, F. W., Wang, J. M., (2000): Flavonoid baicalin inhibits HIV-1 infection at the level of viral entry. Biochem. Biophys. Res. Commun., 276, 534 - 538. Cit. in Mojžiš, Mojžišová, 2001. Miyoshi, E., Shizuri, Y. and Yamamura, S., (1984): Isolation and structures of diomuscione and diomuscipulone from Dionaea muscipula. Phytochemistry, 23, 2385 - 2387. Cit. in Culham, Gornall, 1994. Mojžiš, J., Mojžišová, G., (2001): Flavonoidy a ich biologické účinky. Vienala, Košice, 134 pp. Nakane, H., Ono, K., (1990): Differential inhibitory effects of some catechin derivates on the activities of human immunodeficiency virus reverse transcriptase and cellular deoxyribonukleic and ribonucleic acid polymerases. Biochemistry, 29, 2841 - 2845. Cit. in Mojžiš, Mojžišová, 2001. Ono, K., Nakane, H., Fukushima, M., Chermann, J. C., Barre-Sinoussi, F., (1990): Differential inhibitory effects of various flavonoids on the activities of reverse transcriptase and cellular DNA and RNA polymerases. Eur. J. Biochem., 190, 469 - 476. Cit. in Mojžiš, Mojžišová, 2001. Repčák, M., Galambosi, B., (1994): Ontogenetic aspects of 7-methyljuglone accumulation in some Drosera L. species. Biol. Plant., 36, S232. Repčák, M., Galambosi, B., (1996): Flavonoids in some Drosera species. Biologia, 51, 98 - 99. Repčák, M., Galambosi, B., Takkunen, N., (2000): The production of 7-methyljuglone, quercetin and kaempferol by Drosera anglica and Drosera rotundifolia. Biologia, Bratislava, 55(4), 429 - 433. Reynolds, T., (1987): Comparative effects of alicyclic compounds and quinones on inhibition of lettuce fruit germination. Ann. Bot., 60, 215 - 223. Cit. in Culham, Gornall, 1994. Studnička, M., (1984): Masožravé rostliny. Academia, Praha, 152 pp. Šamaj, J., Blehová, A., Repčák, M., Ovečka, M. ? Bobák, M., (1999): VII. Drosera species (sundew): in vitro culture and the production of plumbagin and other secondary metabolites. In: Biotechnology in agriculture and forestry, 43, Med. and aromat. plants XI, ed. Bajaj I. P. S., Springer-Verlag, Berlin, 105 - 135. Tan, G., Miller, J. F., Kinghorn, A. D., Hughes, S. H., Pezzuto, J. M., (1992): HIV-1 and HIV-2 reverse transcriptases: a comparative study of sensitivity to inhibition by selected natural products. Biochem. Biophys. Res. Commun., 185, 370 - 378. Cit. in Mojžiš, Mojžišová, 2001. Thomson, R. H., (1987): Naturally Occuring Quinones. 3rd edition, London. Cit. in Culham Gornall, 1994. Tomko, J., (1989): Farmakognózia. Osveta, Martin, 424 pp. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||